Medicinska fizika
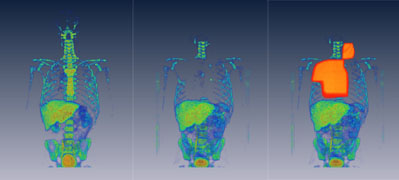 Slika 1:
Serija prvih dveh slik prikazuje celično
proliferacijo, slikano s FLT PET/CT, pred radioterapijo in
po radioterapiji. Tretja slika prikazuje dozno polje poleg
celične proliferacije. Serija slik jasno kaľe kako izgine
celična proliferacija v obsevanem kostnem mozgu.
Slika 1:
Serija prvih dveh slik prikazuje celično
proliferacijo, slikano s FLT PET/CT, pred radioterapijo in
po radioterapiji. Tretja slika prikazuje dozno polje poleg
celične proliferacije. Serija slik jasno kaľe kako izgine
celična proliferacija v obsevanem kostnem mozgu.
Medicinska fizika je aplikativna veja fizike, ki
uporablja fizikalne metode in koncepte za diagnosticiranje
in zdravljenje bolezni. Naąe raziskovanje, ki poteka v
sodelovanju z Oddelkom za medicinsko fiziko in s kliničnim
kolegi iz Carbone Cancer Center Univerze v Wisconsinu, je
osredotočeno na slikovno vodeno terapijo raka*.
V sklopu tega področja je naąe raziskovanje fokusirano v
pet področij:
- Prvo področje je kvantitativno slikanje raka za
karakterizacijo bioloąkih lastnosti tumorjev in za
ocenjevanje odziva na terapijo. Pridobitev kvantitativnih
slikovnih podatkov je pri tem izjemnega pomena. Večina
naąih raziskav temelji na kvatifikaciji tehnik
molekularnega slikanja, predvsem pozitronske emisijske
tomografije (PET) in dinamične kontrastno okrepljene
računalniąke tomografije (DCE-CT).
- Drugo področje je slikanje za celovito določitev
bioloąkih tarč, kar bo olająalo individualno obravnavo in
terapijo pacientov ter tako omogočilo neuniformne dozne
odmerke. Za ta proces se ponavadi uporablja termin "dozno
slikanje" (dose painting).
- Tretje področje je slikanje za oceno učinka terapije na
način, da sedoloči fenotip tumorja pred terapijo in na
podlagi tega predpiąe najbolj primerno vrsto zdravljenja
za vsakega posameznega pacienta. Vključeni smo v več
kliničnih raziskav prve faze, kjer uporabljamo napredne
tehnike molekularnega slikanja za določitev zgodnjega
odziva na terapijo in farmakodinamike različnih novih
zdravil, ki ciljajo predvsem na angiogenezo.
- Četro področje je računalniąko modeliranje rasti
tumorjev in njihovega odziva na terapijo. Cilj je
testirati prepletanja med različnimi bioloąkimi procesi,
optimizirati terapije, napovedati njihovo uspeąnost in
ustvariti nove hipoteze na področju raziskav zdravljenja
raka.
- Zadnje področje raziskav naąe skupine pokriva
odprtokodne medicinske pripomočke. Njihov cilj je
spodbujanje medicinskih raziskav na področju hardware-a in
software-a, ki bodo prosto na voljo raziskovalnim skupinam
po vsem svetu.
* Rak je drugi (po nekaterih statistikah celo prvi)
najpogostejąi vzrokumrljivosti v razvitem svetu, odgovoren
za več kot tretjino vseh smrti, njegova incidenca pa se iz
leta v leto ąe povečuje. Načinov zdravljenja je več,
odvisno predvsem od stadija bolezni. Tri prevladujoče
vrste zdravljenja so radioterapija, kirurgija in
kemoterapija.
Referenca:
LIU, G., JERAJ, Robert, VANDERHOEK, M., PERLMAN, S.,
KOLESAR, Jill M., HARRISON, M.R., SIMONČIČ, Urban,
EICKHOFF, J.C., CARMICHAEL, L., CHAO, B., MARNOCHA, R.,
IVY, P., WILDING, G. Pharmacodynamic Study Using FLT
PET/CT in Patients with Renal Cell Cancer and Other Solid
Malignancies Treated with Sunitinib Malate. Clin Cancer
Res, 17(24), 2011, 7 str., doi:
10.1158/1078-0432.CCR-11-1677. [COBISS.SI-ID 25278759]
Poleg vodje skupine za medicinsko fiziko dr. Roberta
Jeraja, sta člana te skupine še dr.
Urban Simončič and Damijan
Valentinuzzi.
Delovno
področje dr. Urbana Simončiča: Kinetična analiza slik PET
– optimizacija metod in klinične aplikacije
Pozitronska emisijska tomografija (PET) je že precej
uveljavljena slikovna tehnika v moderni onkologiji, a
kvantifikacija slik PET še vedno ni povsem rešen problem.
Kvantitativna informacija se iz slik PET lahko izlušči s
kinetično analizo ali normalizacijo vnosa radiofarmaka v
tkivo. Kinetična analiza je superiorna tako glede količine
informacij, ki se jih dobi s kvantifikacijo slik PET, kot
tudi glede specifičnosti teh informacij. Vseeno pa je
klinična uporaba metod kinetične analize zelo omejena zaradi
kompleksnosti zajema podatkov, in občitljivosti kinetične
analize na slikovni šum. Da bi omilili ta problem, se
ukvarjamo z izboljšavo metodologije kinetične analize.
Kinetično analizo shematsko prikazuje spodnja slika.
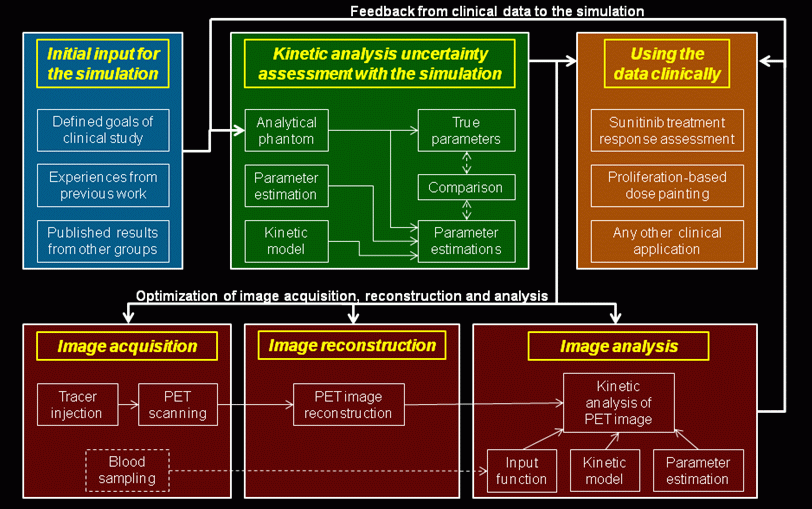
Slika 2:
Shematski prikaz robustnega protokola za
slikanje PET z uporabo kinetične analize. Končen rezultat
tega protokola sestavljata najboljša možna ocena
kinetičnih parametrov in natančna karakterizacija
negotovosti teh parametrov. Da bi dobili te ocene, moramo
sočasno optimirati metodo kinetične analize, zajem slike
in rekonstrukcijo slike. Optimizacijska procedura je
iterativna, z zaporednimi izboljšavami natančnosti
simulacije, ki se uporablja za oceno negotovosti
kinetičnih parametrov.
Razvita metodologija se potem uporablja v kliničnih
študijah. V splošnem sta dva tipa uporabe molekulanega
slikanja in kinetične analize: 1) uporaba slikovnih podatkov
za ocenjevanje posameznikovega odziva na terapijo in vodenje
terapije, 2) uporaba slikovnih podatkov v kliničnih
študijah, kjer se želi odkriti tipično obnašanja populacije
med določenim zdravljenjem.
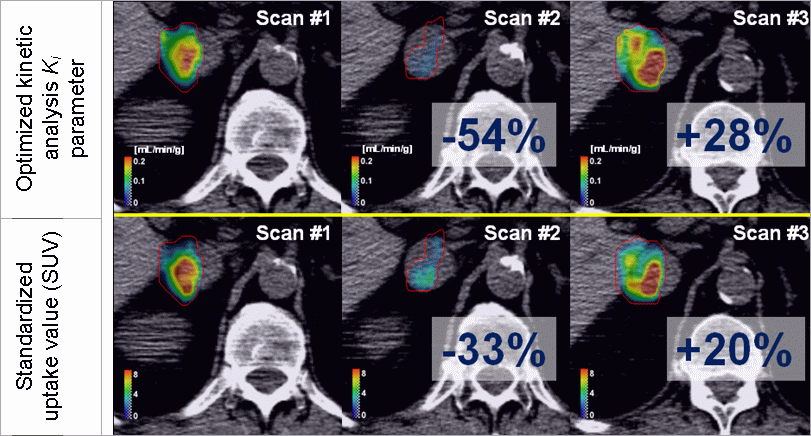
Slika 3:
Primer ocene odziva na zdravljenje s
sunitinibom, s slikanjem FLT PET/CT. Zgornja vrsta
prikazuje kvantifikacijo odziva z optimirano kinetično
analizo, medtem ko spodnja vrsta prikazuje odziv s
standardizirano vrednostjo vnosa. Primer prikazuje, da
optimirana kinetična analiza dá precej drugačne vrednosti
za odziv na terapijo, kot standardizirana vrednost vnosa.
Superiornost optimirane kinetične analize (v smislu večje
natančnosti) se lahko preveri s simulacijami.
Preliminarni rezultati kažejo na izboljšave v oceni
posameznikovega odziva na terapijo in možnost bolj
agresivnega zdravljenja na osnovi bolj natančne slikovne
informacije. Izboljšave natančnosti populacijskih opazljivk
pa so pogosto omejene s heterogenostjo populacije in
izboljšava ocene posameznikovega odziva na terapijo ne vodi
nujno do bolj natančnih populacijskih rezultatov.
Delovno
področje Damijana Valentinuzzija
Ena izmed obetajočih in hitro razvijajočih se metodje
terapija s tarčnimi zdravili, ki vplivajo na točno določene
procese v tumorju. Ko tumor zraste več kot 1-2 mm v
premeru,nujno potrebuje novo ožilje za dostavo hranil in
kisika, hkrati pa služitudi kot izhodna pot rakastim celicam
za metastaziranje v druge dele telesa. Cilj je modeliranje
odziva tumorjev na anti-angiogena zdravila, ki zavirajo rast
novega ožilja. Razviti želimo računalniško simulacijo, ki bo
vsakega pacienta in vsak njegov tumor obravnavala
individualno kot unikum in s pomočjo katerega bo mogoče za
vsakega pacienta izbrati optimalno terapijo, ki bo dala
najboljše rezultate.
Trenutno preučujemo večplastni računalniški model, ki
združuje eksperimentalne podatke iz kliničnih študij na
večji populaciji pacientov s podatki, speicifičnimi za
vsakega posameznika, ki jih pridobimo s pomočjo naprednih
metod slikanja (PET/CT) in s katerimi lahko določimo
heterogenost znotraj rakaste tvorbe (proliferacija,
hipoksija, metabolizem). Menimo, da je prav slabo poznavanje
heterogenosti vsakega posameznega tumorja eden izmed
pomembnih razlogov, zakaj se nekatera zdravljenja ne končajo
po pričakovanjih.
Primer antiangiogenega zdravila, ki je sicer še v fazi
kliničnih testiranj in ki bi ga radi vključili v
računalniško simulacijo, je Axitinib (Pfizer). Zdravilo v
celicah deluje na t.i. VEGF TKI receptorje, ki stimulirajo
rast tumorskega ožilja. Upamo, da bo mogoče z dobrim
računalniškim modelom določiti optimalno doziranje,
napovedati klinični izid in morebitne interakcijepri
kombiniranem zdravljenju, npr. pri kombinaciji z radio- oz.
kemoterapijo. Z njim pa bi radi tudi testirali različne
hipoteze, zakaj pri antiangiogenih terapijah slej kot prej
pride do rezistivnosti tumorjev na ta zdravila, kar je
trenutno eden izmed glavnih problemov.
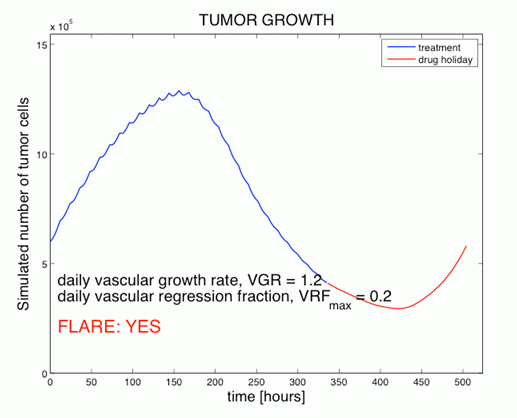
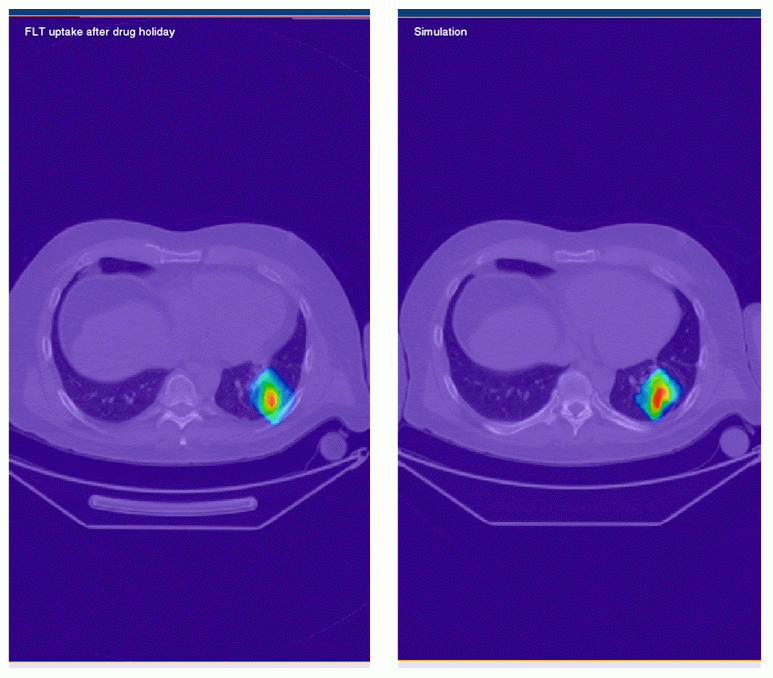
Slika 4 (zgoraj): Simulacija števila tumorskih celic med
antiangiogeno terapijo (modro) in enotedenskim premorom
(rdeče).
(spodaj levo): - prava FLT PET slika celične
proliferacije v tumorju po enotedenskem premoru.
(spodaj desno): - simulirana FLT PET slika celične
proliferacije v tumorju po enotedenskem premoru.









